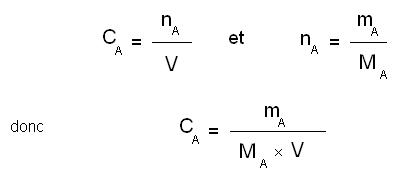Réalisation d'une dissolution
|
|
Choisir une balance avec la précision adéquate. Mettre la balance sous tension. Poser sur le plateau une coupelle et tarer. Prendre le solide avec une spatule propre et sèche. Peser la quantité demandée. |
|
|
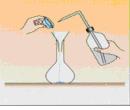
Verser le solide dans une fiole jaugée (rincée à l'eau distillée) à l'aide d'un entonnoir. Rincer la coupelle et l'entonnoir avec de l'eau distillée puis verser cette eau de rinçage dans la fiole pour éviter les pertes. Remplir environ aux ¾ avec de l'eau distillée et agiter jusqu'à dissolution complète du solide. |
|
|
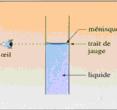
Complétez avec de l'eau distillée jusqu'au trait de jauge et agiter pour homogénéiser la solution. |
Calcul de la concentration finale obtenue
On appelle A le soluté qui est dissout.
mA est la masse de soluté en grammes (g)
MA la masse molaire de soluté (g.mol-1)
nA la quantité de matière de soluté introduite ( mol )
V le volume final de la solution ( celui de la fiole jaugée) en litres (L)
cA la concentration molaire de l'espèce A (mol.L-1)
Remarque : toujours écrire cette petite démonstration et ne pas donner directement la formule finale.
Exemple :
Calculer la concentration de la solution obtenue par dissolution de 20,0 g de saccharose C12H22O11 dans 100 mL d'eau distillée.
Masses molaires : M(H) = 1,00 g.mol-1 M(C) = 12,0 g.mol-1 M(O) = 16,0 g.mol-1
Réponse : c = 5,85.10-1 mol / L