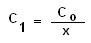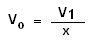Réalisation d'une dilution
|
|
Solution mère = solution de départ que l'on souhaite diluer
|
Solution fille = solution finale
|
|
Concentration en mol.L-1
|
Co
la solution mère a toujours la concentration la plus élevée
|
C1
la solution fille a toujours la concentration la plus faible
|
|
Volume en L
|
Vo
volume qui doit être prélevé
( inférieur au volume final obtenu!)
|
V1
volume final obtenu
|
|
Quantité de matière en mol
|
no = Co x Vo
|
n1 = C1 x V1
|
La quantité de matière de soluté n'est pas modifiée lors de la dilution :
no = n1
Co x Vo = C1 x V1
Remarque : Si on note que la solution mère est diluée x fois, cela veut dire que :
( x est appelé facteur de dilution : x > 1 sinon il n'y a pas dilution!))
 Ne jamais prélever directement dans un flacon!
|
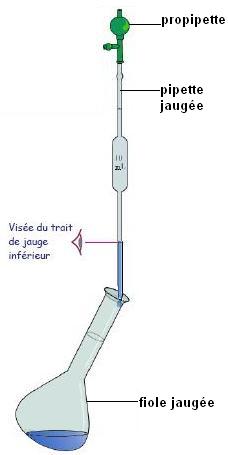 Mettre au départ un fond d'eau distillée dans la fiole jaugée
|
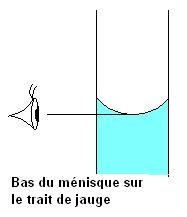
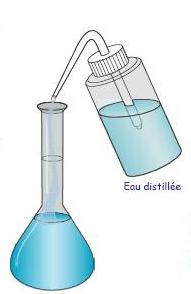 On complète avec de l'eau distillée jusqu'au trait de jauge en agitant au fur et à mesure. (L'ajout final d'eau se fait au goutte à goutte)
|
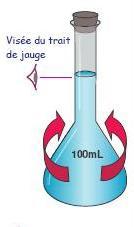 On agite pour rendre la solution homogène
(on vérifie à nouveau le niveau)
|
|
Toute la verrerie est rincée avec la solution correspondante (ici la solution mère), SAUF la fiole jaugée qui est rincée à l'eau distillée.
|
|||
Exemples
-
Calculer la concentration C de la solution obtenue en préparant une dilution d'un volume V0 = 20 mL de concentration C0 = 5.10-2 mol.L-1 de solution de permanganate de potassium (K+ + MnO4-) dans une fiole jaugée de 250 mL.
-
Soit une solution So de diiode de concentration Co = 1,0 x 10-2 mol.L-1. On souhaite préparer à partir de cette solution, 100 mL de solution de diiode 5 fois moins concentrée.
a) Calculez la concentration de la solution obtenue.
b) Quel volume doit-on prélever?
c) Faire la liste de la verrerie nécessaire.